舒泰神(北京)生物制藥股份有限公司
關于 STSG-0002 注射液公示藥物 I期臨床試驗信息的公告
本公司及董事會全體成員保證信息披露內(nèi)容的真實、準確和完整,沒有虛假記載、誤導性陳述或重大遺漏。
舒泰神(北京)生物制藥股份有限公司(以下簡稱“舒泰神”或“公司”)及全資子公司北京三諾佳邑生物技術有限責任公司(以下簡稱“三諾佳邑”)于近日在國家藥品監(jiān)督管理局藥物臨床試驗登記與信息公示平臺公示治療乙型肝炎病毒感染相關疾病的基因藥物“STSG-0002 注射液”的藥物 I 期臨床試驗信息,現(xiàn)將有關情況公告如下:
一、公示的主要試驗信息:
1、登記號:CTR20192024
2、適應癥:慢性乙型肝炎
3、試驗專業(yè)題目:單中心、開放性、劑量遞增評價 STSG-0002 注射液對無癥狀慢性 HBV 感染者的安全性、耐受性及初步有效性 Ia 期臨床試驗及長期隨訪
4、藥物名稱:STSG-0002 注射液
5、主要研究者信息:北京大學第一醫(yī)院王貴強主任、崔一民主任
6、參加機構(gòu)信息:北京大學第一醫(yī)院
二、藥品其他相關情況
STSG-0002 注射液是具有自主知識產(chǎn)權(quán)的國家 I 類治療用生物制品,公司及子公司三諾佳邑于 2019 年 06 月 18 日向國家藥品監(jiān)督管理局申報關于STSG-0002 注射液的新藥臨床試驗申請并于 2019 年 06月 27 日獲得受理,屬于“特殊審批程序”品種。2019 年 09 月 19 日收到國家藥品監(jiān)督管理局簽發(fā)的《臨床試驗通知書》,通知書號為 CXSL1900065。 STSG-0002 注射液申報臨床試驗的適應癥為:慢性乙型肝炎。乙型肝炎病毒(HBV)感染是嚴重威脅全球健康的主要問題之一。根據(jù) WHO 發(fā)布的《Global hepatitis report, 2017》,全球有超過 2.57 億人慢性感染;每年有超過 88.7 萬人死于該病毒。中國是 HBV 高發(fā)國家,2006 年中國 HBV 血清流行率調(diào)查顯示,中國 1~59 歲人群的 HBsAg攜帶率為 7.18 %。因此,估計中國約有 9300 萬人感染了乙肝病毒,其中 2000 萬為乙肝病毒慢性乙肝患者。慢性乙型肝炎給患者的生活帶來巨大的痛苦和經(jīng)濟負擔。
目前在中國已上市的抗 HBV 核苷(酸)類(nucleos(t)ide, NAs)藥物包括核苷類的拉米夫定(Lamivudine, LAM)、替比夫定(Telbivudine, LDT)、恩替卡韋(Entecavir, ETV)和核苷酸類的阿德福韋(Adefovir, ADV)、替諾福韋(Tenfovir, TDF)。NA類藥物可通過抑制 DNA 逆轉(zhuǎn)錄酶活性而抑制 HBV 的復制,盡管現(xiàn)有的抗病毒治療藥物能夠有效降低患者血清中 HBV DNA 的拷貝數(shù),甚至達到檢測下線水平,但是這些藥物對 HBsAg(乙型肝炎表面抗原)和 HBeAg(乙型肝炎 E 抗原)的產(chǎn)生無直接抑制作用。目前國際慢性乙型肝炎的治療方法均無法有效降低 HBsAg 抗原,其是導致肝硬化、肝癌的促進因素。此外,干擾素(interferon IFN)具有直接抗病毒作用和免疫調(diào)節(jié)作用,可有效提高機體免疫力,但只能注射給藥,持續(xù)應答率低,副作用多且治療費用高昂。
目前致力于 HBV 小干擾 RNA 作用機制的研發(fā)產(chǎn)品共有 6 家公司的 7 個產(chǎn)品,5 個產(chǎn)品均處于臨床 I 期和 II 期。根據(jù)臨床試驗注冊情況,均以 HBeAg 陽
性或陰性慢性乙型肝炎作為首選適應癥進行開發(fā),具體見下表:
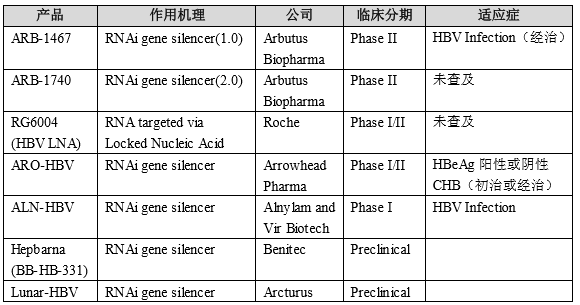
STSG-0002 注射液為攜帶靶向 HBV 基因組 P 區(qū)和 X 區(qū)的 shRNA 序列表達框的肝噬性復制缺陷重組腺相關病毒。它以重組腺相關病毒(rAAV)作為遞送載體,將目的基因序列導入細胞轉(zhuǎn)錄生成 shRNA,shRNA 在細胞質(zhì)中剪切為單鏈 siRNA,隨后通過 RNAi 機制,特異性地沉默 HBV 復制相關的 pgRNA 和 HBV蛋白表達相關的 sRNA,阻斷 HBV 病毒復制,降低 HBsAg、HBeAg 和 HBc 蛋白的合成和分泌。STSG-0002 具有明顯嗜肝性,單次靜脈給藥可在肝細胞內(nèi)長期表達 siRNA。HBsAg 的大幅度降低有望促進 HBsAg 血清轉(zhuǎn)化,從而實現(xiàn) HBV功能性治愈。
STSG-0002 注射液項目的研發(fā)成功將有效解決現(xiàn)有乙型肝炎患者抗病毒治療方案不能直接降低 HBsAg(乙型肝炎表面抗原)等 HBV 相關結(jié)構(gòu)蛋白和調(diào)節(jié)蛋白的問題,有效降低 HBV 攜帶者肝臟 HBV 復制帶來的慢性炎癥,從而阻止慢性乙型肝炎患者向肝硬化、肝癌等重型肝病的進展,并將對 HBV 感染相關重癥疾病帶來新的治療手段。
公司已聘請衛(wèi)生部國家感染病臨床重點專科建設學科負責人、北京市內(nèi)科(傳染病)重點學科帶頭人、中華醫(yī)學會感染病學分會主任委員,北京大學第一醫(yī)院感染疾病科主任王貴強教授;中國藥理學會藥物臨床試驗專業(yè)委員會候任主任委員、中國藥理學會臨床藥理學專業(yè)委員會候任主任委員、中國藥理學會藥物基因組學專業(yè)委員會副秘書長,北京大學第一醫(yī)院臨床試驗中心主任、藥劑科主
任崔一民教授作為 STSG-0002 項目 I 期主要研究者。
三、風險提示
本次公示治療乙型肝炎病毒感染相關疾病的基因藥物“STSG-0002 注射液”的藥物 I 期臨床試驗信息是新藥研發(fā)進展的階段性步驟,后續(xù)能否獲得國家藥品監(jiān)督管理局的生產(chǎn)批件、獲準上市尚存在諸多不確定。公司將積極推進上述研發(fā)項目,并按有關規(guī)定對該項目后續(xù)進展情況及時履行信息披露義務。 由于醫(yī)藥產(chǎn)品具有高科技、高風險、高附加值的特點,藥品的前期研發(fā)以及產(chǎn)品從研制、臨床試驗報批到投產(chǎn)的周期長、環(huán)節(jié)多,容易受到技術、審批、政策等諸多因素影響。敬請廣大投資者謹慎決策,注意防范投資風險。
特此公告
舒泰神(北京)生物制藥股份有限公司
董事會
2019 年 12 月 23 日

